백과사전 상세 본문
요약 각 원소의 각기의 특징을 잃지 않는 범위에서 도달할 수 있는 최소의 미립자.
목차
펼치기그리스어로 '쪼갤 수 없는'이라는 뜻의 아토모스(atomos)에서 유래된 말로 특히 화학반응에 관계하는 화학원소의 최소단위에 사용된다. 그렇다고 해서 화학 이외의 방법으로 원자를 더욱 분할할 수 없는 것은 아니다. 실제로 여러 가지 물리적 수단에 의해 원자를 분할하는 것은 흔한 일이 되었다.
성분과 성질
구성 입자와 힘
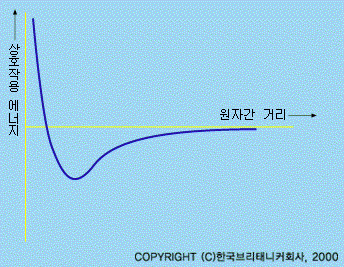
대부분의 물질은 분자덩어리로 이루어져 있는데, 이것은 비교적 쉽게 쪼개진다. 그런데 분자는 끊어지기 어려운 화학 결합에 의해 연결된 원자로 구성되어 있다. 각각의 원자는 더 작은 입자인 전자와 핵으로 이루어져 있다. 이 입자들은 하전되어 있고, 이들 사이의 전기적 힘에 의해 함께 원자를 구성한다. 이 더 작은 입자를 쪼개려면 더 많은 에너지가 드는데, 그결과 생성되는 것은 새로운 원자구성입자들이다.
원자는 대부분 빈 공간으로 이루어져 있다. 핵은 원자의 양으로 하전된 중심이고, 원자 질량의 대부분이 들어 있다. 핵은 양으로 하전된 양성자와 전하를 갖고 있지 않는 중성자로 되어 있다. 이 양성자와 중성자를 합해서 핵자라고 부른다. 양성자·중성자, 그리고 그들을 둘러싸고 있는 전자는 수명이 긴 입자이다. 다른 원자구성입자들은 이 3종류의 입자와 결합된 상태로 발견되는데, 만들려면 매우 큰 에너지가 들며 수명이 아주 짧다.
모든 원자의 크기는 대략 같아 원자의 반지름은 1~2Å(옹스트롬)이다. 원자의 전체 크기에 비해서 핵은 더 작다. 그 비는 공깃돌과 축구장의 비와 같다. 부피로 보면 핵은 원자 공간의 10-14밖에 차지하고 있지 않다. 양성자는 단단하고 양으로 하전되어 있는 입자이다. 반면에 중성자는 전하를 갖고 있지 않으며, 질량은 양성자와 거의 같다. 가장 가벼운 핵은 1개의 양성자로 된 수소의 핵으로 이것은 전자보다 1,836배나 더 무겁다.
전자는 원자 내에서 복잡한 행동을 보이지만, 몇 가지 매개 변수에 의해서 완전하게 기술될 수 있다. 전자는 전하, 질량, 스핀, 자기 모멘트 등의 고유한 성질을 가지고 있다. 모든 전자는 같은 성질을 가지고 있다. 전자는 존재하는 가장 가벼운 입자로서 더 작은 것으로 쪼개질 수 없기 때문에 절대적으로 안정하다. 전자의 전하와 질량은 아래표에 나와 있다. 전자는 전자기력뿐만 아니라 중력과 약력(핵의 방사성 붕괴로 나타남)의 영향을 받는다.
원자가 가지는 대부분의 성질은 핵을 둘러싸고 있는 전자의 행동에 의해서만 좌우된다. 원자의 화학적 성질은 핵 주위의 전자구름이 놓여 있는 상태에 달려 있다. 한 원소의 원자는 다른 원소의 원자와 전자의 수가 다르다. 원자핵의 특성은 그 속에 들어 있는 양성자와 중성자의 수에 의해서 결정된다. 핵은 전하와 질량 외에 스핀과 자기 모멘트를 가질 수 있다. 핵자 사이의 힘에는 전자에 작용하는 3가지 힘뿐만 아니라 강력도 포함되어 있는데, 이 힘은 다른 어떤 힘보다 훨씬 더 강하다.
강력 때문에 핵결합 에너지는 원자 내에서 전자의 결합 에너지보다 100만 배나 더 강하다. 따라서 핵변환시에 방출되는 에너지량은 원자 내의 전자배열이 바뀔 때 나오는 에너지보다 크다.
핵 속의 양성자와 중성자는 양자역학의 법칙에 따라 기술된다. 각각의 양성자와 중성자도 그 자체의 내부 구조를 갖고 있는데 이 구성성분을 쿼크라고 한다. 더 큰 단위의 물질을 구성할 수 있는 입자와 달리 쿼크는 핵자로부터 분리될 수 없고 고립상태에서 연구될 수 없다. 쿼크 사이에서 작용하는 강력은 너무 강하기 때문에, 그들은 결코 완전하게 분리될 수 없다.
쿼크를 포함하고 있는 입자를 전체적으로 하드론(강입자)이라고 부른다. 강입자는 중입자와 중간자로 분류된다. 중입자는 3개의 쿼크로 구성되어 있는데 그 예로는 양성자와 중성자가 있다. 중간자는 2개의 쿼크를 가지고 있는데 여기에서 대부분의 핵력이 나온다.
핵자를 제외한 이 모든 입자는 만들어진 후 불과 몇 분의 1초 안에 붕괴되고 만다. 원자구성입자를 가르는 더 넓은 부류가 하나 있는데, 이것은 경입자이다. 전자와 중성미자는 경입자이다. 이것들은 어떤 검지가능한 내부 구성성분을 가지고 있지 않으며, 자연의 참된 기본 입자라고 볼 수 있다. 중성미자는 질량이 없거나 작은 하전되지 않은 입자로서, 핵의 방사성 붕괴과정중에 생성된다.
| 기호 | 값 | |
| 아보가드로수 | NA | 6.022 X 1023mol-1 |
| 기본전하 | e | 1.602 X 10-19C |
| 패러데이 | F | 9.649 X 104Cmol-1 |
| 플랑크 상수 | h | 6.626 X 10-34J·s |
| %">ħ=h/2π | 1.055 X 10-34J·s | |
| 전자의 질량 | me | 9.11 X 10-31kg |
| 전자의 정지 에너지 | mec2 | 8.2 X 10-14J= |
| 5.11 X 05eV | ||
| 양성자의 질량 | mp | 1.673 X 10-27kg |
| 양성자의 정지 에너지 | mpc2 | 1.50 X 10-10J= |
| 938.3MeV | ||
| 보어 반지름 | ao | 5.292 X 10-11m= |
| 0.5292Å | ||
| 빛의 속력(진공) | c | 2.998 X 108·S-1 |
원자번호
원자의 가장 중요한 특징으로 핵 속의 양전하 단위의 수로 정의된다. 중성의 원자는 같은 수의 양성자와 전자를 가지고 있기 때문에, 양전하와 음전하는 정확하게 균형을 이루고 있다. 원자번호는 원자의 화학적 성질을 결정한다.
원자 질량수
원자 내의 핵자의 총수를 말한다. 원자번호는 같지만 원자 질량이 다른 원자를 동위원소라고 한다. 동위원소는 동일한 화학적 성질을 가지고 있지만, 원자핵의 성질은 매우 다를 수 있다.
원자량
한 원소의 일정한 수의 원자가 가진 질량을 말한다. 거시적 양의 원자를 다루는 표준 과학 단위는 mol(몰)인데, 이것은 탄소의 동위원소 12C가 12g 속에 들어 있는 원자의 수와 같은 수를 가지는 물질의 양으로 정의된다. 1mol 속의 원자의 수는 아보가드로수라고 하는데, 그 값은 약 6×1023이다.
전하
보통의 원자는 전기적으로 중성이다. 그러나 화학 반응이나 다른 입자와의 충돌로 전자를 잃거나 얻는 원자들도 있다. 전하를 지닌 원자는 이온이라고 한다. 중성의 원자가 전자를 잃으면 양이온이 되고, 전자를 얻으면 음이온이 된다.
전자껍질
원자 내의 전자의 행동은 대단히 미묘하고, 양자역학 법칙의 지배를 받는다. 이 법칙에 따르면 전자들은 궤도함수라고 하는 원자 내의 여러 다른 영역을 점유하고 있다. 궤도함수는 간단하게 핵을 둘러싸고 있는 구름이라고 생각할 수 있다. 전자를 많이 갖고 있는 원자에서 전자는 각각 고유한 궤도함수를 가지고 있는데, 이것은 파울리의 배타원리로 알려져 있는 양자역학의 법칙에 따르고 있다(→ 파울리의 배타 원리).
따라서 많은 전자를 가지고 있는 원자에서는 여러 종류의 궤도함수가 각각의 전자들에 의하여 채워져 있다. 동일하거나 거의 동일한 에너지를 가지고 있는 궤도함수의 집단을 전자껍질이라고 한다. 전자껍질이 차 있거나 비어 있음에 따라 원소의 특성이 달라진다(→ 에너지 상태, 전자 볼트).
화학적 행동
원자의 화학적 성질은 느슨하게 결합된 전자껍질에 좌우된다. 화학 원자가는 파울리 원리에 의해서 나온 것인데, 이 원리에 의하면 한 원소의 원자는 간단한 계수 규칙에 따라 다른 원소의 규정된 수만큼의 원자와 결합한다(→ 원자가결합이론). 이 전자껍질이 헬륨의 경우처럼 완전히 채워져 있으면, 전자는 단단히 결합되어 있기 때문에 화학 결합이 쉽사리 일어나지 않는다. 하지만 리튬처럼 최외각에 전자가 하나밖에 없으면 이 전자는 약하게 결합되어 있어서 원자가 쉽게 이온화될 수 있다.
고대 그리스의 원자 철학과 실험과학
원자 철학은 레우키포스에서 시작되었다고 추정된다(→ 그리스 철학). 그의 제자인 데모크리토스는 BC 430년경에 아토모스라는 물질에 관한 철학을 발전시켰다. 데모크리토스는 원자는 균일하고, 단단하고, 무게 있고, 압축되지 않고, 파괴되지 않으며, 빈 공간에는 수많은 원자가 돌아다니는데, 원자의 형태와 크기의 차이가 물질의 다양한 성질을 결정한다고 생각했다. 데모크리토스의 철학에서 원자는 물질뿐만 아니라 감각이나 인간의 영혼 같은 성질들의 구성요소이기도 하다.
예를 들면 신맛은 바늘처럼 생긴 원자 때문에 나타나는 것이며, 영혼의 원자는 특히 미세하다고 생각되었다. 에피쿠로스는 그리스의 미신적인 공포를 덜어주기 위해서 데모크리토스의 사상을 이용했다. 에피쿠로스의 유물론적 철학에 따르면 우주 전체는 원자와 빈 공간으로만 구성되어 있으며, 심지어는 신도 자연법칙에 종속되어 있었다. 로마의 시인이자 철학자였던 루크레티우스는 원자론을 대중화하기 위해서 〈사물의 본성에 관하여 De rerum natura〉라는 긴 시를 썼는데, 이 시는 15세기에서 다시 발견되었고 프랑스의 신부 피에르 가생디가 발간·대중화하여 17세기에 정통적인 아리스토텔레스식의 관점과 새로운 실험과학 사이에 논쟁을 일으키는 매개역할을 했다.
그후 갈릴레오 갈릴레이는 진공이 존재한다고 말했고, 과학자들은 아리스토텔레스의 정설과 원자론의 우열을 가리기 위해서 공기와 부분진공의 성질을 연구하기 시작했다. 아일랜드 태생 영국의 화학자 로버트 보일은 1658년 공기에 대한 체계적인 연구를 시작하여 1662년에는 공기에 관한 최초의 물리법칙을 발표했는데, 그것은 2개의 변화하는 양, 즉 부피와 압력의 함수관계를 기술하는 것이었다(→ 보일). 이것은 보일의 법칙으로 알려져 있다(→ 보일의 법칙). 공기의 압력에 관한 실험 후 보일은 모든 물질은 단단한 입자로 구성되어 있으며, 이 입자는 물질에 서로 다른 성질을 주는 분자를 형성한다고 썼다. 그는 모든 물체는 하나의 보편물질로 구성되어 있는데, 이 보편물질은 형태·크기·운동 등에서만 차이가 있다고 했다.
18세기말경에 가서야 화학자들은 화학물질의 결합에 대하여 이해하기 시작했다. 1794년에 조세프 루이 프루스트는 일정성분비의 법칙을 발표했는데, 이 법칙의 내용은 화합물의 성분은 항상 같은 비의 무게로 결합한다는 것이었다(→ 프루스트).
현대 원자론의 시작
원자론의 실험적 기초
1803~08년에 영국의 화학자·물리학자였던 존 돌턴은 프루스트의 연구를 확장하여 그리스의 원자론을 과학 이론으로 바꾸었다. 그는 자신의 원자설에서 다음 가설을 사용하여 일정성분비의 법칙을 올바로 설명하는 데 성공했다. ① 물질은 분할할 수 없는 원자로 구성되어 있다.
② 특정 원소의 원자는 무게 등의 성질이 모두 같다. ③ 다른 원소는 다른 종류의 원자를 가지고 있다. 특히 서로 다른 원소의 원자는 그 무게가 서로 다르다. ④ 원자는 소멸하지 않고 화학반응은 단지 원자의 재배열에 지나지 않는다. ⑤ 원소로부터 화합물이 형성되는 이유는 각 원소의 원자를 일정수만큼 포함하는 '복합원자'가 형성되기 때문이다(→ 배수비례의 법칙).
돌턴의 이론은 몇 가지 중요한 문제를 해결하지 못했다. 그의 이론으로는 원자의 절대 무게와 크기를 결정할 수 없을 뿐만 아니라, 다른 원자의 상대 무게도 정확하게 결정할 수 없다. 이 문제는 기체의 연구에 의해서 처음으로 해결되었다.
1809년 화학자 게이 뤼삭은 기체가 서로 화학적으로 반응할 경우 그 기체의 부피는 간단한 정수비를 이룬다는 것을 출판했다.
예를 들면 수소와 산소의 혼합기체를 전기불꽃으로 폭발시킬 경우, 두 부피의 수소와 한 부피의 산소가 결합하여 두 부피의 수증기가 형성된다. 이러한 성질을 요약한 기체반응의 법칙은 일정성분비의 법칙에 대응하는 것임이 밝혀졌다. 그후 이탈리아의 A. 아보가드로는 1811년에 다음의 2가지 가설을 제안했다.
① 기체의 원자는 원자로 분리되어 존재하는 것이 아니라 서로 결합하여 분자로 존재한다. ② 같은 부피의 기체는 모두 같은 수의 분자를 포함하고 있다. 이 아보가드로의 원자·분자 이론은 1858년에 스타니슬라오 칸니차로에 의해서 재평가되어 일반적으로 인정받게 되었다(→ 칸니차로, 아보가드로 법칙).
원자량과 주기율표
19세기에 점점 더 많은 원소가 발견되어감에 따라 과학자들은 원소의 물리적 성질과 그 원자량이 어떤 관련이 있는지 생각하기 시작했다. 러시아의 화학자인 드미트리 이바노비치 멘델레예프는 1869년에 원소를 원자량에 따라 배열하면 그 성질의 독특한 주기성이 나타난다고 발표했다. 멘델레예프는 수소를 제외하고 당시에 알려져 있던 63개의 원소를 원자가에 따른 6개의 족으로 배열했다.
원소를 결합하는 능력인 원자가는 화합물 속의 원소의 비를 결정한다.
존재 증명
전자
전자가 발견되고 그 전하량과 질량이 측정된 것은 원자론과 중요한 관련이 있다.
왜냐하면 1833년에 M.패러데이가 처음으로 인식했듯이 전기분해에서는 질량의 이동과 전하의 이동 사이에 밀접한 관계가 있기 때문이다. 전기분해법에 의해서 어떤 원소의 1g 원자량을 석출하기 위해서는 1패러데이라고 하는 일정량의 전기량을 통과시킬 필요가 있다. 이 사실은 전기도 원자론적이라는 것, 그리고 전기분해시에 원자가 기본 전하량 또는 그 정수배를 운반한다는 것의 증거가 된다.
만약 이 기본 전하량이 전자와 같다는 것이 입증되면 그것을 원자의 실재성을 입증하는 데 사용할 수 있을 것이다.
전자의 전하와 같은 전기량이 단위 전기량이라는 것은 전기분해뿐만 아니라 기체를 통한 전기전도에서도 확인되었다. 두 과정에서 모두 양과 음의 대전체가 모두 존재한다는 것이 밝혀졌다. 진공에서의 기체방전에서 자기장과 전기장에 의해서 진로가 변하는 것을 이용하여 이 대전체의 전하 대 질량의 비(비전하)를 결정할 수 있다.
J. J. 톰슨은 1897년에 음의 대전체는 고립된 전자라는 것을 증명했다. 1898년 독일의 물리학자 빌헬름 빈이 실행한 양극선 연구에 의해서 양의 대전체의 비전하는 전자의 비전하값보다 1,000배나 크며, 전기분해에서 발견된 양의 대전체의 비전하와 비슷하고 방전관 내의 기체의 성질에 의해서 결정된다는 것이 밝혀졌다. 이 사실은 전류의 양의 부분이 개별 원자 또는 분자에 의해서 운반된다는 것이 매우 유력하다는 증거였다.
방사능
더욱 직접적이고 명확한 증거는 방사능으로부터 얻어졌다.
1903년에 J. 엘스터, H. 가이텔, W. 크룩스는 방사성 물질에서 나오는 알파선이 황화아연의 형광판에 충돌하면, 각각 분명하게 구별되는 형광을 발하는 것을 관측했다. 같은 해에 러더퍼드 및 그와 독립적으로 T. 데 쿠드르는 전자기장 내에서의 알파선의 휘어짐을 관측하여, 그 비전하가 수소방전관 내에서 만들어진 양극선의 비전하와 비슷하다는 것을 보였다.
브라운 운동
방사능과 전기 현상은 정상 상태에 있는 보통의 물질이 입자구조를 가지고 있다는 것의 완전한 증명은 아니라는 반론이 제기되었는데, 1908년에는 그러한 반론의 근거가 제거되었다.
그해에 장 페랭은 아인슈타인이 1905년에 제창한 이론에 의거하여 미립자를 유체 속에 넣었을 경우에 그것이 받는 끊임없는 운동에 관해서 상세하게 연구했다(페랭). 이 운동은 1827년에 이것을 처음으로 연구한 브라운을 기념하여 브라운 운동이라고 한다.
브라운 운동은 미립자가 더욱 작은 유체분자로부터 받는 충격의 직접적인 결과로 해석할 수 있다. 이러한 해석은 1877년경에 이미 제창되었지만, 이 운동을 물체 운동론의 기초로도 삼을 수 있다는 것을 보인 사람은 아인슈타인과 페랭이었다.
이 사실이 밝혀진 후에는 원자의 실재성에 관한 문제는 과학적이기보다는 오히려 철학적 문제로 되었다. 그러나 다행히도 수년 후에 X선을 사용하여 결정고체 내의 원자의 규칙적인 배열이 해명되어 원자간 거리를 직접적으로 측정할 수 있게 되었다. 이러한 측정으로 결정의 일정한 부피 내에 있는 원자수를 실제로 계산할 수 있었으며, 아보가드로 수를 결정하는 가장 정확한 기초가 되었다.
원자구조 모형
개요
톰슨에 의한 전자의 발견은 이미 1897년에 물리학자들에게 이론적인 문제를 던져주었다.
왜냐하면 원자는 전체적으로 볼 때 전기적으로 중성이기 때문이다. 문제는 원자를 중성화하는 양전하는 어디에 있고 무엇이 그것을 그 자리에 붙잡아 두는가 하는 것이었다. 1903~07년에 톰슨은 이 의문을 풀기 위해서 1902년에 켈빈이 처음으로 제안한 원자모형을 이용했다. 이 모형에 의하면 원자는 전하가 균일하게 퍼져 있는 공이고, 전자는 그 속에 규칙적으로 박혀서 양전하를 중성으로 만든다.
러더퍼드의 핵 모형
1911년에 어니스트 러더퍼드는 그의 금박지 실험에서 톰슨의 모형이 틀렸다는 것을 증명했다.
이 실험에서 그는 원자는 작은 핵을 가지고 있으며, 원자의 질량은 그 핵에 집중되어 있다는 결론을 내렸다. 그러나 많은 물리학자들은 러더퍼드의 핵 모형을 믿지 않았다. 왜냐하면 그것은 원자의 화학적 행동과 조화되지 않기 때문이었다.
모즐리의 X선 실험과 원자번호
1913년 모즐리는 다른 원소에 전자를 쏘았을 때 만들어지는 X선을 연구했는데, 그결과 가장 가벼운 원소에서 가장 무거운 원소까지 다양한 형태의 선명한 스펙트럼선이 아주 규칙적으로 추적될 수 있다는 것을 보였다. 특정한 X선의 진동수의 제곱근을 원소의 원자량에 대해 도시하면 점들은 거의 직선의 형태로 배열된다.
그러나 원자량 대신에 원자번호를 사용하면 더욱 완전하게 직선과 일치한다. 원자번호는 주기율표에서 원자의 순위를 나타내는 번호이다. 모즐리 자신이 지적한 대로 특별한 원자구조의 이론에 의하지 않더라도 이 정수(원자번호)가 원자의 참된 지표라는 것은 이 X선 스펙트럼으로 아주 명백해졌다. 더욱이 그는 이 측정결과를 보어의 이론과 결합하여 원자번호는 원자핵이 지닌 단위 정전기량의 수와 일치한다는 것을 분명하게 증명했다.
보어 모형
1913년에 보어는 전자가 어떻게 핵 주위의 안정한 궤도를 가질 수 있는지를 설명하기 위해 양자화된 전자껍질 모형을 제안하고 2가지 가설을 세웠다.
① 전자는 원자핵 주위를 원 궤도에 따라 움직이며, 전자가 취할 수 있는 궤도는 그 궤도의 각 운동량이 h/2π의 정수배인 궤도뿐이다. 이 궤도들은 전자가 그 어떤 궤도에 머물러 있는 한은 에너지를 방사하지 않는다는 의미에서 '정상'이다. ② 전자는 하나의 궤도에서 다른 궤도로, 두 궤도의 에너지 차이에 해당하는 에너지를 방출하거나 흡수함으로써 전이할 수있다. 보어의 모형은 원자의 안정성을 설명할 수 있었으며, 수소원자의 스펙트럼선에 대한 발머 공식도 설명할 수 있었다.
그러나 보어의 이론은 중대한 결함을 가지고 있었다. K와 L 계열의 X선 스펙트럼을 제외하면 2개 이상의 전자를 가진 원자의 성질은 설명하지 못했던 것이다. 그후 많은 물리학자들은 보어 이론을 수정했지만 1920년대초에 보어 모형은 막다른 길에 다다른 것처럼 보였다. 그것은 대부분의 미세 스펙트럼선이나 비정상 제만효과를 설명하지 못했으며, 결국 이 모형으로 다전자 원자에 대해서 일반화하려는 노력은 헛되다는 것이 드러났다.
양자역학의 법칙
그후 몇 안에 과학자들은 일관된 원자이론을 발전시켰는데, 이 것은 원자의 기본 구조와 그 상호작용을 설명할 수 있었다.
이 발전에 결정적이었던 것은 빛과 물질은 원자나 원자구성입자의 수준에서는 파동과 입자 2가지 성질을 모두 가지고 있다는 것이었다(파동입자이중성). 1923년에 드 브로이는 모든 물질과 빛은 입자와 파동의 성질을 가지고 있다고 제안했다. 그러나 드 브로이의 제안은 영감에 의한 것이었고, 실험적·이론적 기초를 가지고 있지 않았다.
이에 대한 이론은 오스트리아의 물리학자 에르빈 슈뢰딩거가 제공했다. 그래서 1926년까지 물리학자들은 파동역학이라고도 하는 양자역학의 법칙을 발전시켜 원자나 원자구성입자의 현상을 설명할 수 있게 되었다.
슈뢰딩거의 파동 방정식
1926년에 슈뢰딩거는 양자역학을 넓게 적용할 수 있는 형태의 수학적인 파동 방정식을 만들어냈다(슈뢰딩거 방정식). 슈뢰딩거는 원자 내의 전자는 파동으로 간주되어야 한다고 가정했다.
원자의 서로 다른 에너지 준위는 파동 방정식의 간단한 진동 양식으로 볼 수 있으며, 이 양식을 발견하기 위해서 방정식을 푸는 것이다. 그후에 진동 양식의 진동수와 아인슈타인 공식으로부터 전자의 에너지가 얻어진다. 1929년에 노르웨이의 물리학자 E. 힐레라스는 슈뢰딩거 방정식을 2개의 전자를 가진 헬륨 원자에 적용했다.
그는 단지 근사값을 얻었을 뿐이지만 그의 에너지 계산은 매우 정확한 것이었다. 2전자 원자에 대한 힐레라스의 설명으로 물리학자들은 슈뢰딩거 방정식이 정확한 해답을 제공할 수는 없다 하더라도 원자수준의 자연을 기술하기 위한 강력한 수학적 수단이 될 수 있음을 알게 되었다.
반입자의 존재
영국의 물리학자 P. A. M. 디랙은 1928년 전자에 대한 새로운 방정식을 도입했다.
슈뢰딩거 방정식은 상대성 원리를 만족시키지 못하며, 따라서 그것은 빛의 속도보다 훨씬 천천히 움직이는 입자에서 나타나는 현상을 기술하는 데만 사용될 수 있다. 상대성 이론을 만족시키기 위해서 디랙은 전자에 대해서 하나가 아니라 4개의 서로 다른 파동함수를 가정해야 했다. 이들 중 둘은 2개의 스핀 방향에 대응하는 것이고, 나머지 둘은 그때까지 관측되지 않은 전자의 상태와 관련된 것이었다.
디랙은 이것을 전자와 반대되는 전하를 가진 반입자라고 해석했다. 1932년에 미국의 물리학자 C. D. 앤더슨은 양전자를 발견함으로써 반입자의 존재를 증명했는데, 이로 인해 디랙 이론이 옳다는 것이 입증되었다. 이 발견 후에 원자구성입자들이 더이상 변환 불가능한 것은 아니라고 생각되었다.
본 콘텐츠의 저작권은 저자 또는 제공처에 있으며, 이를 무단으로 이용하는 경우 저작권법에 따라 법적 책임을 질 수 있습니다.
화학과 같은 주제의 항목을 볼 수 있습니다.